Mit dem bundesweiten Start des Lungenkrebs-Screenings in Deutschland rückt eine technologische Entwicklung in den Fokus, die das Potenzial hat, die radiologische Diagnostik grundlegend zu verändern: die Integration von Künstlicher Intelligenz in die Befundung. Das Kernspinzentrum Hamburg gehört zu den Vorreitern auf diesem Gebiet – nicht nur im Rahmen des gesetzlich definierten Screenings, sondern auch durch den flächendeckenden Einsatz von KI in der gesamten Thorax-Bildgebung.
Gesetzliche Grundlage trifft auf Innovationsdrang
Seit dem Inkrafttreten der Lungenkrebs-Früherkennungsverordnung ist klar: Der Einsatz computerassistierter Systeme in der Diagnostik ist nicht mehr optional, sondern verpflichtend. „Die neue gesetzliche Grundlage sieht explizit vor, dass die CT-Aufnahmen zunächst ohne und anschließend mit einer Software zur computerassistierten Detektion befundet werden müssen“, erklärt Benjamin Kalender, Geschäftsführer von Med AI Solutions und Vertriebspartner von ClariPi. Ziel sei es, die Qualität und Objektivität der Befundung zu erhöhen – und gleichzeitig die Radiologinnen und Radiologen im Alltag zu entlasten.
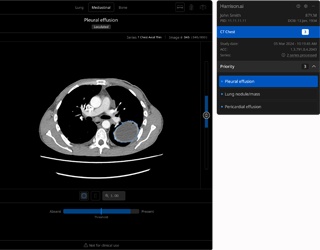
Die Anforderungen an die eingesetzte Software sind hoch: Sie muss Lungenrundherde erkennen, ihr Volumen präzise berechnen, deren Volumenverdopplungszeit (VDT) ermitteln und strukturierte Befunde liefern. Dabei ist die Integration in bestehende radiologische Workflows entscheidend. „Die Software darf keine zusätzlichen Arbeitsschritte verursachen, sondern soll die Effizienz steigern“, so Kalender.
Praxisnaher Einsatz in Hamburg: flächendeckend statt selektiv
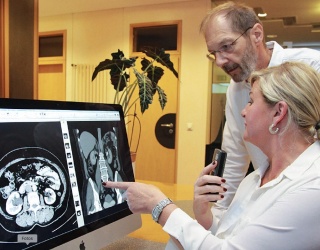
Im Kernspinzentrum Hamburg verfolgt man einen konsequent anderen Ansatz. „Wir setzen die Lösung von ClariPi nicht nur für Screening-Patienten ein, sondern prinzipiell bei jeder Thorax-CT“, betont Jan-Timo Ackerstaff, Radiologe am Kernspinzentrum Hamburg und Mitinitiator des Projekts. „Ziel ist eine zukunftsorientierte Thorax-Diagnostik – standortübergreifend, vergleichbar und präzise.“

Der Vorteil dieses Ansatzes liegt auf der Hand: Durch die flächendeckende Anwendung der KI können auch Inzidentalbefunde standardisiert und nachvollziehbar bewertet werden. „Wir haben sieben Standorte mit insgesamt über 18.000 Thorax-CTs pro Jahr – da macht es keinen Sinn, KI nur selektiv einzusetzen“, ergänzt Marcel Apel, der als Geschäftsführer das Kernspinzentrum Hamburg leitet. „Daher war unsere Devise von Anfang an: Was sinnvoll ist, wird allen Patienten angeboten.“
Technische Umsetzung? Überraschend simpel
Trotz des technologischen Anspruchs ist die Implementierung der ClariPi-Software vergleichsweise unkompliziert. „Der Hardwareanschluss ist technisch schnell möglich, klinische Validierung, IT-Freigabe und Datenschutzprüfungen benötigen jedoch weitere Vorlaufzeit“, erklärt Ackerstaff. „Das kann innerhalb weniger Stunden umgesetzt werden.“
Darüber hinaus erfolgt das Routing der CT-Daten automatisch an den ClariPi-Server. „Wenn der Radiologe den Fall aufruft, liegen die KI-Ergebnisse bereits im PACS als separates Piktogramm vor“, so Ackerstaff. Die Befunde lassen sich dann bei Bedarf noch verfeinern oder direkt übernehmen – vollautomatisiert, aber stets unter ärztlicher Kontrolle.

KI als Werkzeug – nicht als Ersatz
Trotz aller Automatisierung bleibt der Radiologe das letzte Glied in der Entscheidungskette. „Die KI unterstützt, aber sie entscheidet nicht“, betont Marcel Apel. „Die Radiologin oder der Radiologe muss die Befunde validieren und freigeben.“ Genau darin liege der entscheidende Unterschied zur allgemeinen KI-Debatte: In der Radiologie agiert KI als Assistenzsystem, nicht als Ersatz menschlicher Expertise.
Die eingesetzte Lösung von ClariPi erfüllt dabei nicht nur die formalen Anforderungen der Verordnung, sondern geht über diese hinaus. „Strukturierte Befunde, präzise Volumetrie, automatische VDT-Berechnung – das ist keine Rocket Science, aber es muss sauber implementiert sein“, sagt Benjamin Kalender.
Herausforderungen bei der Umsetzung
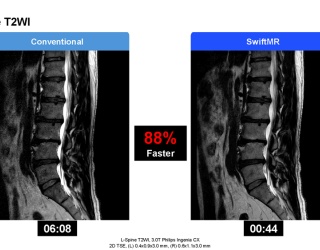
Ein zentrales technisches Problem liegt laut Kalender in der Standardisierung: Unterschiedliche CT-Protokolle, Rekonstruktionsalgorithmen und Gerätemodelle beeinflussen die Messgenauigkeit erheblich. „Unterschiede im Rekonstruktionskernel können das gemessene Volumen eines Rundherds um über 40 % verändern – bei exakt denselben Rohdaten.“ Hier helfen KI-basierte Rauschreduktion und Normalisierungsverfahren, um reproduzierbare Ergebnisse zu erzielen.

Auch bei der klinischen Anwendung gibt es Fallstricke. So dürfen laut Vorgabe bestimmte Klassifikationen – wie etwa die LUNG-RADS-Kategorien – nur bei echten Screening-Patienten angewendet werden. Für alle anderen Fälle gelten weiterhin die Fleischner-Kriterien. „Wichtig ist, zwischen Screening- und Diagnostik-Kontext zu unterscheiden: LUNG-RADS ist für organisierte Low-dose-CT-Screenings entwickelt worden, während für inzidentell gefundene Rundherde die Fleischner-Kriterien gelten. Bei einer flächendeckenden KI-Anwendung muss der Kontext „Screening vs. klinische Indikation“ eindeutig dokumentiert und im Befund ausgewiesen werden, damit Managementempfehlungen korrekt angewendet werden“, merkt Jan-Timo Ackerstaff an.
Flankierende Maßnahmen: Aufklärung und Prävention
Ein zentrales Anliegen am Kernspinzentrum Hamburg bleibt die Aufklärung der Bevölkerung. „Rauchentwöhnung ist die effektivste Einzelmaßnahme zur Reduktion des Lungenkrebsrisikos; Screening ergänzt, ersetzt sie jedoch nicht“, so Ackerstaff. „Am Ende wollen wir nicht nur mehr CTs machen, sondern einen Beitrag zur Prävention leisten.“ Gleichzeitig sieht man im ganzheitlichen Ansatz – also dem Zusammenspiel von radiologischer Diagnostik und ärztlicher Aufklärung – eine Chance, neue Zielgruppen zu erreichen, die nicht in das klassische Screening-Schema passen. Das zeigt, dass KI auch ein Kommunikationsinstrument sein kann – und kein Selbstzweck.
Screening als Impulsgeber – aber der Blick geht weiter
Das Beispiel des Kernspinzentrum Hamburg zeigt eindrucksvoll, wie gesetzliche Vorgaben nicht nur umgesetzt, sondern innovativ interpretiert werden können. Die KI-Lösung von ClariPi wird hier nicht auf das gesetzlich geforderte Minimum reduziert, sondern strategisch als Werkzeug zur Qualitätssteigerung genutzt – im Sinne der Patienten, der Zuweiser und der Radiologen selbst. Oder wie es Marcel Apel auf den Punkt bringt: „Warum den Weg gehen, wie alle – wenn man ihn besser gehen kann?“