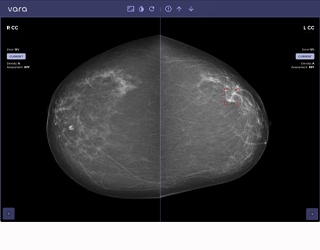
Neue Technologien finden ihren Weg in die Radiologie heute schneller denn je und ihre erfolgreiche Einführung entscheidet darüber, ob ihr Potenzial den klinischen Alltag wirklich erreicht. Das gilt nicht nur für KI, neue MR-Sequenzen oder Dual-Energy, sondern ebenso für photonenzählende Systeme. Die dedizierte Spiral- Brust-CT mit Photon-Counting-Technologie ist ein besonders gutes Beispiel dafür, weil sie als neuartige Modalität in etablierte diagnostische Abläufe eingreift und gewisse strukturelle, personelle und klinische Voraussetzungen braucht, um sich als Innovation erfolgreich in den Workflow zu integrieren. Gleichzeitig steht sie exemplarisch für die Zukunftstendenz einer personalisierten Präzisionsdiagnostik: weg vom Einheitsverfahren, hin zu individuell passender Bildgebung.
RadMag hat mit drei Experten gesprochen, die den Prozess aus unterschiedlichen Perspektiven erlebt haben: Prof. Thomas Frauenfelder (Institutsdirektor am Institut für diagnostische und interventionelle Radiologie, Universitätsspital Zürich), Dr. Karsten Ridder (Radiologe und Standortleiter Dortmund am MVZ Prof. Dr. Uhlenbrock und Partner, „Breast-radiologist of the Year 2023“), und Dr. Felix Althoff (Chief Innovation Officer bei AB-CT – Advanced Breast-CT, Erlangen).
Wenn eine neue Technologie in die Radiologie kommt, entscheidet sich ihr Erfolg selten an der Bildqualität allein – sondern an Integration, Teamprozessen und Akzeptanz. Welche Voraussetzungen müssen erfüllt sein, damit eine Modalität wie die photonenzählende Brust-CT im klinischen Alltag ankommt?
Prof. Thomas Frauenfelder (TF): Die photonenzählende Brust-CT ist eine eigenständige Modalität, technisch nicht aus bestehenden CT-Systemen abgeleitet. Sie nutzt eine speziell für die Brust entwickelte spiralförmige Akquisition und einen photonenzählenden Detektor. Diese erstmals in einem dedizierten Brust-CT realisierte Kombination erklärt, warum bei ihrer Einführung nicht nur medizinische, sondern auch organisatorische und IT-bezogene Abläufe neu gestaltet werden mussten. Die Integration ist dabei die eigentliche Herausforderung. In Zürich arbeiten wir mit einem 20-Minuten-Takt, kombiniert mit Mammographie und Ultraschall. Aber die Abstimmung bleibt entscheidend – von der Aufnahme bis zur Befundung. Ein wichtiger Aspekt ist die Datenmenge. Die Brust-CT erzeugt große Volumina, die IT-seitig sauber integriert werden müssen. Wir arbeiten an Methoden, die die Brustdichte früher im Prozess erfassen, um Folgeuntersuchungen direkt anschließen zu können.
Gleichzeitig ist sie für uns ein komplementärer Bestandteil der Diagnostik: Wir bieten sie vor allem Frauen an, die aufgrund von Schmerzen oder negativen Erfahrungen keine Mammographie mehr wünschen. Jede Patientin wird unmittelbar nach der Untersuchung informiert und erhält bei Bedarf eine Biopsie oder weiterführende Diagnostik.
Dr. Karsten Ridder (KR): Am Anfang war der organisatorische Aufwand groß: Aufklärung der Zuweiser, Schulung des Teams, Integration in bestehende Abläufe. Wichtig war, alle Beteiligten mitzunehmen, insbesondere Gynäkologinnen und Gynäkologen, die verstehen müssen, wo das Verfahren seinen Platz hat.
Heute sehen wir, dass die Technik neue Patientinnen erreicht. Etwa 20 % der Frauen lehnen die Mammographie aufgrund der schmerzhaften Kompression ab. Für diese Gruppe kann die Brust-CT eine niederschwellige Möglichkeit sein, eine hochwertige Diagnostik ohne Kompressionsschmerz zu erhalten.
Dr. Felix Althoff (FA): Die Einführung einer neuen Modalität berührt immer drei Bereiche gleichzeitig: technische Machbarkeit, organisatorische Integration und Akzeptanz bei Anwendern und Patientinnen. Dass es sich bei unserem von Prof. Willi Kalender entwickelten Gerät um das weltweit erste dedizierte Spiral-Brust-CT mit Photon-Counting-Technologie handelt, hat diesen Prozess zusätzlich geprägt, weil für viele Abläufe und Schnittstellen zunächst Lösungen geschaffen werden mussten.
Dazu gehören stabile Rekonstruktionszeiten, kompatible IT-Prozesse, klare Workflows und klinische Module wie die neue Biopsie-Einheit. Solche Weiterentwicklungen erleichtern die Integration maßgeblich und machen aus der Modalität ein vollwertiges diagnostisches Werkzeug.

Photon-Counting gilt als Schlüsseltechnologie der neuen CT-Generation. Welche Eigenschaften machen sie für die Brustbildgebung besonders geeignet?
TF: Wir vergleichen die Brust-CT natürlich mit der Mammographie. Anfangs war das Umdenken groß. Der Bildeindruck ist anders, die Artefakte sind spezifisch. Aber wer die Lernkurve durchläuft, erkennt, dass die Qualität mindestens gleichwertig ist. Mit Kontrastmittel erreichen wir eine diagnostische Aussagekraft auf MRT-Niveau, jedoch in einer deutlich angenehmeren Untersuchungssituation für die Frauen.
KR: Wir bewegen uns dosismäßig im Bereich der Mammographie, mit Potenzial nach unten, wenn man das volle Leistungsvermögen der Technologie ausschöpft und moderne Denoising-Verfahren nutzt. Gleichzeitig erreichen wir eine höhere Spezifität, insbesondere in kontrastmittelgestützten Untersuchungen. Und: Mikrokalk, der in der MRT nicht sichtbar ist, wird in der CT brillant abgebildet.
FA: Photon-Counting liefert bei niedriger Dosis eine sehr hohe Auflösung. Wir erleben hier die erste Generation photonenzählender Brust-CT-Systeme, und bereits jetzt zeigt sich ein klarer technologischer Fortschritt. Der spezielle Akquisitionsansatz wurde für die Brust entwickelt und ermöglicht eine vollständige volumetrische Darstellung ohne Kompression.

Wie gelingt es, eine neue Modalität so zu integrieren, dass sie nicht neben, sondern innerhalb etablierter Abläufe funktioniert?
TF: Die Brust-CT ist kein Hochdurchsatzgerät. Wir arbeiten mit einem kombinierten Takt aus Mammographie, Ultraschall und CT. Die großen Datenmengen müssen sauber integriert werden. Wir arbeiten daran, die Brustdichte früher zu erfassen, um Folgeuntersuchungen direkt anschließen zu können.
FA: Wir haben Rekonstruktionszeiten deutlich reduziert und durch die Biopsie-Einheit ein klinisch wichtiges Modul ergänzt. In präklinischen Tests dieser Einheit erfassten Radiologen alle Läsionen, bei Interventionszeiten unter 15 Minuten. Solche Fortschritte erleichtern die Alltagstauglichkeit erheblich.
Wie lässt sich heute differenziert über Strahlenexposition und Aussagekraft sprechen?
FA: Viele denken bei CT automatisch an hohe Dosis. Tatsächlich handelt es sich hier um ein hochauflösendes Organsystem. Mit Photon-Counting erreichen wir Dosiswerte im Bereich der Mammographie oder Tomosynthese, bei gleichzeitig vollwertigen 3D-Informationen. Diese Fehlannahme zur Strahlenexposition war zu Beginn weit verbreitet und zeigt auf, wieviel Aufklärungsarbeit Hersteller bei der Einführung einer neuen Technologie leisten müssen.
KR: Das Brust-CT muss mindestens auf dem Niveau der Mammographie liegen, besser darunter. Das Potenzial sehen wir – erste interne Daten zeigen, dass wir äquivalent oder niedriger liegen könnten.
TF: Entscheidend ist, dass wir diagnostisch nichts verpassen. Die Bildqualität muss so sein, dass Mikrokalk oder subtile Dichteunterschiede sicher erkennbar sind.
Bei welchen klinischen Fragestellungen hat sich die Brust-CT besonders bewährt, und wo bleibt sie eine Ergänzung?
TF: Besonders bewährt hat sie sich bei Implantaten. Wir beurteilen Implantatdichtigkeit und Drüsengewebe, inklusive Mikrokalk. Auch Patientinnen mit Schrittmachern oder MRT-Kontraindikationen profitieren. In solchen Fällen ist für mich die Brust-CT die Methode der Wahl.
KR: Bei Implantaten habe ich keine Blindspots wie in der Mammographie. Drehungen oder Defekte erkennt man eindeutig. Bei multizentrischen oder lobulären Karzinomen ist das CT ein hervorragendes präoperatives Planungsinstrument, besonders für Frauen, die keine MRT wollen oder haben können.
Welche Rolle spielt KI in der Diagnostik mit der Brust-CT?
TF: Wir setzen KI heute noch nicht in der eigentlichen Grunddetektion ein, sondern sehen ihr Potenzial vor allem im Workflow. Ich wünsche mir Systeme, die BIRADS-1- und -2-Fälle automatisch erkennen, sinnvoll vorstrukturieren und dazu gleich passende Berichte erstellen. Das würde uns enorm entlasten. Der große Effizienzgewinn entsteht nicht durch einen zusätzlichen Second Reader, sondern durch kluge Automatisierung im Reporting und in der Befundkommunikation.
KR: Mit Hilfe von KI können wir diese Entscheidungen künftig viel präziser treffen – also, welche Frau in welchem Intervall welches Verfahren braucht. Ein wichtiger Baustein ist dabei die automatische Dichte-Bewertung. Auf dieser Grundlage kann KI Screening-Intervalle und Untersuchungsverfahren individueller steuern – unter Einbezug von Brustdichte, familiärer Belastung, bisherigen Befunden und dem individuellen Risikoprofil.
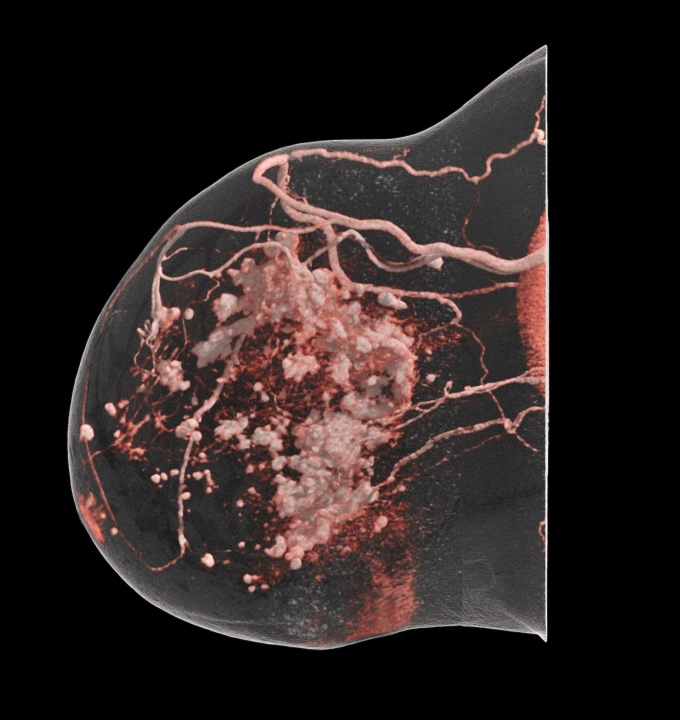
Wie reagieren Ihre Patientinnen auf die neue Untersuchungsmethode, und wie informieren Sie die Zuweiser?
TF: Die Rückmeldungen der Patientinnen sind durchweg sehr positiv. Viele empfinden die Mammographie als entwürdigend. Sie nennen vor allem das Quetschen der Brust, das Entblößen und oft die Hektik der Untersuchung. Die Brust-CT ist schmerzfrei, schnell und wahrt die Privatsphäre, was das Untersuchungserlebnis grundlegend verändert. Auffällig ist, dass viele Frauen auf Empfehlung anderer kommen: Die meisten Patientinnen erfahren durch Mund-zu-Mund-Propaganda von der Methode. Rund 30 bis 40 Zuweiser schicken regelmäßig Patientinnen. Die Mammographie bleibt die erste Wahl, aber das Bewusstsein für die Brust-CT als gezielte Option wächst.
KR: Für die Patientinnen hat die schmerzfreie Untersuchung eine enorm emotionale Bedeutung. Viele Frauen informieren sich heute selbst und oft sind es Freundinnen, die sie auf die Brust-CT aufmerksam machen. Manche reisen sogar hunderte Kilometer, weil sie genau diese angst- und schmerzfreie Diagnostik möchten.
In den ersten Monaten bestand meine Hauptarbeit darin, die zuweisenden Gynäkologinnen und Gynäkologen sowie alle, die im senologischen Netzwerk tätig sind, neutral und transparent über Stärken und Grenzen des Systems aufzuklären. Dabei zeige ich immer reale Fälle, weil sie das Verfahren greifbar machen. Die Erfahrung zeigt: Wenn die Vorteile verstanden werden, wird die Brust-CT sehr schnell als sinnvolle Ergänzung akzeptiert.

Wo steht die Brust-CT klinisch – und wie sieht es international aus?
FA: Unser Gerät ist in den Universitätskliniken in Erlangen, Zürich und Leiden im klinischen Einsatz und in Radiologie-Praxen in Deutschland. Die Nutzung erfolgt für die Früherkennung wie auch in der Diagnostik, mit und ohne Kontrastmittel. Auch die plastische Chirurgie zählt zu den Anwendungsbereichen. International sind wir in Kliniken in Südkorea und bald auch in Australien vertreten.
KR: In rund 50 unserer Fälle haben wir Aufnahmen sowohl aus MRT als auch aus kontrastmittelgestützter CT. Im direkten Vergleich gibt uns die zusätzliche Darstellung des Mikrokalks im CT inzwischen eine deutlich höhere diagnostische Konfidenz. Die Technik liefert das, was man erwartet, auf sehr hohem Niveau.
Welche Entwicklungen werden die Brustbildgebung in den nächsten Jahren prägen?
TF: Wir brauchen Methoden, die falsch positive Befunde reduzieren und zugleich sensitiv bleiben, idealerweise ohne Strahlung und ohne Kompression.
KR: Ich sehe eine personalisierte Präzisionsdiagnostik, bei der jede Frau je nach Risikoprofil, Brustdichte und Präferenzen das optimale Verfahren erhält.
FA: Frauen angepasst nach Risikoprofil untersuchen zu können, bedeutet für Hersteller flexible Systeme zu entwickeln, die sich in individualisierte diagnostische Pfade einfügen lassen. Mit unserem Brust-CT-Gerät sehen wir uns hierzu auf dem richtigen Weg.